BATERIA (QUÍMICA E FÍSICA)

A bateria é um componente ou dispositivo capaz de transformar uma reação química em corrente elétrica para suprir a necessidade de um circuito ou sistema. De modo geral, o termo acumulador é mais comumente usado para designar um conjunto de células voltaicas ou células eletroquímicas capazes de manter contínuo o fornecimento de energia a um circuito elétrico ou sistema elétrico por mais tempo que o tempo de fornecimento normal de uma simples pilha, embora também seja possível usar a expressão pilha recarregável para designar o dispositivo capaz de fornecer energia a sistemas elétricos ou circuitos elétricos menores, que demandam menos energia.
De modo geral, a maioria das fabricantes de baterias estabelecidas no Brasil é confiável e produz baterias de qualidade.
BASE TEÓRICA
A oxirredução ou reação de oxirredução é um fenômeno químico comum na natureza em que há, entre outras coisas, produção de energia elétrica a partir da ocorrência simultânea da oxidação e redução de espécies químicas. Nesse caso específico quando se fala em redução o significado é de ganho de elétrons e quando se fala em oxidação o significado é de perda de elétrons. É importante que o leitor não se confunda com esse conceito, pois ele parece confuso mesmo, afinal, de modo geral, quando se fala em “redução”, na linguagem comum, na linguagem do dia a dia, a primeira coisa que vem à mente do leigo é de diminuição de algo.
Esse fenômeno químico está diretamente relacionado com a produção de energia elétrica por meio de pilhas e baterias, mas não apenas isso, pois ele também está relacionado com a corrosão ou ferrugem dos metais sólidos, com as técnicas antigas de fotografia, com o processo de fermentação de bebidas, com a combustão da gasolina, com a respiração de humanos e animais e com o fenômeno da fotossíntese das plantas, dentre outros.
É importante que o leitor entenda que a redução é o processo em que ocorre o ganho de elétrons e a oxidação é o processo em que ocorre perda elétrons. O conceito do número Nox, conhecido também como número de oxidação, indica a tendência que os átomos dos elementos ou da matéria têm de ganhar ou perder elétrons. Se não houver transferência de elétrons entre um átomo e outro não há produção de energia a partir de pilhas e baterias.
A principal característica desse fenômeno é a transferência de elétrons de um átomo oxidado para um átomo reduzido próximo, como, por exemplo, na reação química de pilhas e baterias. Essa transferência de elétrons nas reações de oxirredução produz energia na forma de calor, no entanto a transferência de elétrons nestas reações também pode produzir energia na forma de eletricidade. Uma particularidade das reações de oxirredução é que são termodinamicamente favoráveis, isto é, são reações espontâneas.
A chamada eletronegatividade é a capacidade ou característica que um átomo tem de atrair elétrons para si. Ela é maior em átomos de menor raio, ou seja, quando menor a distância entre o núcleo do átomo e a sua eletrosfera (camada exterior) então maior é sua capacidade de atrair elétrons. Quando maior o raio então maior é capacidade de perder elétrons.
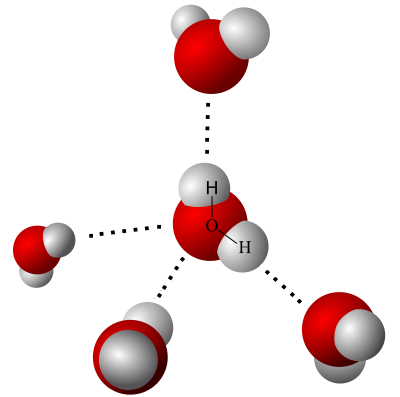
Por exemplo, a água é uma substância formada por moléculas que combinam três átomos, sendo dois átomos de hidrogênio e um átomo de oxigênio. Se houver ruptura na ligação covalente desses átomos, o átomo de oxigênio, que é o que possui maior eletronegatividade recebe um elétron de cada um dos dois átomos de hidrogênio, adquirindo a partir de então carga Nox de -2, enquanto cada um dos átomos de hidrogênio passa a ter carga Nox de +1.
CONFUSÃO
ACADÊMICA
Antigamente, o termo oxidação significava "combinar-se com o oxigênio". Mas, quando se adquiriu o conhecimento da estrutura dos átomos, verificou-se que, quando um elemento ou uma substância se combinava com o oxigênio, esta espécie química "perdia elétrons". A partir de então, o termo oxidação passou a significar "perder elétrons", ou ainda "aumento da reatividade", não necessariamente em presença de oxigênio, e o ganho de elétrons por uma espécie química passou a ser considerado uma redução.
Nas pilhas, por exemplo, existem dois eletrodos. O eletrodo em que ocorre a oxidação é chamado de ânodo e o eletrodo onde ocorre a redução é chamado de cátodo. É importante também que o leitor leigo entenda que o agente químico redutor é aquele que provoca redução (ganho de elétrons) em outro agente químico. Parece confuso, né? Por isso é necessário prestar muita atenção. A espécie química que recebe os elétrons, ou seja, que sofre redução, é chamada de agente oxidante. Parece que as "coisas estão invertidas", mas é assim mesmo.

No século XVII, o físico alemão Otto von Guericke inventou a primeira máquina de produzir eletricidade estática. Na década de 1730, o físico e astrônomo inglês Stephen Gray descobriu que a eletricidade poderia ser transmitida por meios condutores de eletricidade, principalmente os metais, e isolada por materiais isolantes, como o vidro.

Apenas para efeito didático de comparação, grosso modo, a bateria é prima da pilha, mas a pilha nasceu antes, em 1799, pelas mãos do físico e químico italiano Alessandro Volta. As pilhas são consideradas células eletroquímicas primárias e as baterias são consideradas células eletroquímicas secundárias. Elas fazem parte da mesma família de componentes elétricos. Embora também exista pilha recarregável, há algumas diferenças básicas entre bateria e a pilha:
- A bateria é formada por várias pilhas em série ou paralelas, agrupadas, formando um conjunto aparentemente único, o que resulta no fornecimento de corrente elétrica com voltagem mais alta que, comumente, a voltagem de uma pilha avulsa.
- As baterias podem ser compostas de diversos materiais, tamanhos e potências, enquanto as pilhas são, de modo geral, mais simples. De modo geral, embora nem sempre, as pilhas são mais compactas e leves, podendo caber dentro de relógios, inclusive.
- Nas baterias a composição química que possibilita o processo químico que dá origem à carga elétrica pode ser recomposta, regenerada ou mantida por meio do recarregamento por meio de energia elétrica fornecida por um gerador ou carregador conectado na tomada de energia alternada, por exemplo. Assim, após o recarregamento, o processo eletroquímico, que é o ponto de partida para geração de energia, pode ser reiniciado ou mantido quantas vezes forem necessárias, até o fim da vida útil da bateria.
TIPOS DE PILHAS

Os padrões mais populares de pilhas modernas seguem, mais ou menos, o antigo modelo original conhecido como Pilha de Daniell, inventado pelo químico britânico John Daniell, em 1836, quando o avanço da telegrafia criou a necessidade urgente de uma fonte de corrente elétrica confiável e estável. Essa pilha consiste na imersão de um fio de zinco a uma solução aquosa de sulfato de zinco, assim como um fio de cobre em solução aquosa de sulfato de cobre, mantendo os dois metais interligados eletricamente por um fio.
- Ânodo = local onde ocorre oxidação, é o polo negativo da pilha, a partir do qual fluem os elétrons quando está conectada a um circuito elétrico em funcionamento;
- Cátodo = local onde ocorre redução, é o polo positivo da pilha, para onde vão os elétrons que fluem pelo circuito;
- Eletrodo = peça metálica condutora destinada a permitir o contato com um condutor diferente;
PILHA
COMUM
Conhecida também como pilha seca, ela foi criada por Georges Leclanché em 1866, a partir dos conceitos e descobertas de outros estudiosos, como Luigi Galvani, Alessandro Volta, Humphry Davy, John Daniell, Antoine César e Gaston Planté, e entre suas principais características está o uso de uma estrutura cilíndrica simples, formada pela combinação de um eletrodo positivo, um eletrodo negativo em forma de invólucro de chapa de zinco, um bastão de grafite cilíndrico no seu núcleo e uma pasta úmida de NH4 e MNO2.
PILHA
ALCALINA
Sua fabricação em série foi iniciada em 1949 e entre suas principais características está o uso de uma estrutura cilíndrica formada por um recipiente em aço, um tubo estrutural isolante e um separador, combinados com um eletrodo positivo, um eletrodo negativo, um ânodo de zinco em pó e um eletrólito KOH na forma pastosa e alcalina, em substituição ao hidróxido de potássio da pilha comum, e um cátodo de dióxido de manganês.
PILHA
DE ÓXIDO DE PRATA
Trata-se de uma pilha compacta, pequena e leve e boa capacidade de fornecimento de eletricidade, numa comparação de tamanho com os demais tipos de pilhas, sendo muito usada em relógios de pulso, calculadoras portáteis e agendas eletrônicas. Sua estrutura é formada por um copo metálico, cujo interior está preenchido com um ânodo de zinco, um cátodo de AG2O e uma tampa.
|
TAMANHOS DE PILHAS DISPONÍVEIS
ATUALMENTE NO MERCADO |
||
|
TAMANHOS |
DIÂMETRO |
COMPRIMENTO |
|
A |
17 milímetros |
50 milímetros |
|
AA |
14,2 milímetros |
50 milímetros |
|
AAA (palito) |
10,5 milímetros |
45 milímetros |
|
|
|
|

De modo geral, o nível de eficiência das baterias tem melhorado a cada nova década, embora em um ritmo menor que o desejado pelos consumidores. A indústria mundial tem feito um esforço contínuo pela melhora da performance das baterias em geral, mas o desenvolvimento de novas tecnologias é considerado lento pelos consumidores. Atualmente, entre as baterias mais eficientes, usadas por aparelhos eletrônicos, está a bateria de lítio-íon, usada em larga escala, com peso menor, durabilidade maior e melhor capacidade de armazenamento. Mesmo assim, ela ainda tem uma performance limitada, consegue manter energizado um smartphone ou notebook, por exemplo, por no máximo 24 horas, em uso moderado, às vezes nem isso.

Também chamada de bateria automotiva ou acumulador de chumbo, ela foi o primeiro tipo de bateria recarregável a ser inventada, em 1859, pelo físico francês Gaston Planté, mas é claro que atualmente é fabricada em versões mais modernas, embora o conceito seja basicamente o mesmo. Ela é responsável por manter os circuitos elétricos de automóveis, caminhões e barcos energizados, mesmo quando os motores estão desligados. Ela é composta por chumbo e uma solução aquosa de ácido sulfúrico (H2SO4).
Atenção: O ácido sulfúrico possui ação altamente desidratante e
corrosiva dos tecidos orgânicos de humanos e animais, podendo até provocar
queimaduras graves da pele, formando manchas pretas.

Conhecida também como bateria de íon-lítio ou bateria de íons de lítio, ela é, atualmente, um dos mais modernos e eficientes acumuladores com fabricação em larga escala. A primeira bateria de lítio foi inventada pelo físico e químico americano Gilbert Newton Lewis, em 1912, mas somente a partir de 1970 as primeiras baterias de lítio ficaram disponíveis comercialmente.

Conhecidas também pelo sigla Ni-Mh, essas baterias substituíram em vários mercados as baterias de níquel-cádmio, substituindo o cádmio por uma liga de metais não tóxicos. Elas chegaram ao mercado mundial em 1989 para serem usadas em aparelhos eletrônicos em geral e até em satélites, mas, com o passar do tempo, percebeu-se que algumas limitações das baterias de níquel-cádmio também estavam presentes nas baterias de níquel-hidreto metálico, embora com menos gravidade, principalmente o efeito memória.

De acordo com estimativas, a indústria de produção de baterias movimenta mais US$ 50 bilhões de dólares por ano em todo o mundo, mas, atualmente, ela enfrenta pelo menos cinco desafios técnicos e econômicos, o tamanho, o peso, o aquecimento, a pouca potência e a pouca longevidade. De modo geral, elas possuem mais volume do que deveriam, têm mais peso do que deveriam, esquentam mais do que deveriam, possuem voltagem baixa e duram pouco. As baterias de lítio-íon, por exemplo, estão entre as mais modernas e eficientes que existem, apresentam a melhor combinação de características alcançadas pela indústria eletrônica, inclusive com a melhor performance já encontrada em baterias fabricadas em larga escala, mas não conseguem suprir um smartphone moderno ou notebook por mais de 24 horas, mesmo que em uso moderado.
- Amazônia
- ATR-42
- ATR-72
- Abdução (Ufologia)
- Saab JAS 39 Gripen NG
- Extraterrestre (Ufologia)
- Beechcraft Corporation
- Programa FX2 (Força Aérea Brasileira)
- Controle de Qualidade
- Agricultura e Pecuária
- Pesos e Medidas
- Ônibus Espacial
- UFO/ OVNI (Ufologia)
- Galvanização (Química)
- Cessna 208B Grand Caravan
- Cessna Citation
- Intelbras (Telecomunicações)
- HDL (Segurança Eletrônica)
- Leucotron (Telecomunicações)
- Bombardier Learjet
- Apicultura (Mel e Própolis)
- Neiva (Indústria Aeronáutica)
- Caso ET de Varginha
- Cirrus Aircraft
- Satélites (Telecomunicações)
- Indústria Automobilística
- Disco Voador (Ufologia)
- Agronegócios / Agribusiness (Economia)
- Granito e Mármore (Construção Civil)
- Rumo ALL (Companhia Ferroviária)
- Aquecimento Global
- Embraer KC-390
- Saneamento Básico
- Bombardier (Indústrias de Veículos)
- Embraer
- Transportes no Brasil (Logística)
- Energia Solar Fotovoltaica
- Operação Prato (Ufologia)
- Energia Elétrica
- Boeing 737
- Paul Mauriat (Música)
- Área 51 (Ufologia)
- Conexão ADSL (Telecomunicações)
- Aeroporto Campo de Marte
- Material Composto
- Segurança Privada
- Novatel Teleinformática
- Drones
- Nobreak (Informática)
- Piper Aircraft
- James Bond (Cinema)
- Embarcações (Indústria Naval)
- Roteadores (Telecomunicações)
- Aeroporto de Congonhas
- Aeroporto Santos Dumont
- Cal (Construção Civil)
- Embraer EMB-314 Super Tucano
- Embraer AMX (Força Aérea Brasileira)
- Pastagem ou Pasto (Agropecuária)
- Maconha (Segurança Pública)
- Ford do Brasil
- Airbus A320
- General Motors do Brasil
- FAB - Força Aérea Brasileira
- Embraer E-190
- Franquia de Internet (Telecomunicações)
- Crase (Gramática)
- Embraer E-195
- Airbus A321
- Casa C-295 (Força Aérea Brasileira)
- Airbus A319
- Computador (Informática)
- Volkswagen Delivery
- Açúcar (Agroindústria)
- Música Eletrônica (Indústria Fonográfica)
- Unidade Embraer Botucatu
- Ford Ranger
- Aeronaves (Indústria Aeronáutica)
- Chevrolet S10
- Água (Biologia e Química)
- Ford F-250
- Kia Bongo
- Circuito Eletrônico (Eletrônica)
- Conservação de Alimentos (Culinária)
- Aviação Agrícola (Agricultura)
- Álcool (Agroindústria)
- Abrasivos (Indústria)
- Lockheed Hercules (Força Aérea Brasileira)
- Alumínio (Metalúrgica)
- Antibióticos (Medicina e Veterinária)
- Hyundai HD 80
- Hyundai HD 78
- Aquecedor Solar de Água
- Fibrocimento NT (Construção Civil)
- Caminhões Mercedes-Benz Atego
- Honda HA-420 HondaJet
- Água Oxigenada (Química)
- Atmosfera (Química e Física)
- IRPF - Imposto de Renda de Pessoa Física
- Navios (Engenharia Naval)
- Barcos (Engenharia Naval)
- Bicicleta (Ciclismo)
- Mata Bicheiras (Agropecuária)
- Hughes Network Systems
- Contêineres (Transporte de Cargas)
- Modem (Telecomunicações)
- Embraer EMB-203 Ipanema
- Tijolo (Construção Civil)
- Aquífero Guarani (Geografia)
REFERÊNCIAS E SUGESTÃO DE LEITURA
- Integrando Conhecimento / YouTube: https://www.youtube.com/watch?v=qkVpHwjQNk4
- Nova Enciclopédia Ilustrada Folha – Larousse / Cambridge / Oxford / Webster
- Livros Didáticos Integrados do Sistema de Ensino Positivo - Ensino Médio
- Wikipédia: https://pt.wikipedia.org/wiki/C%C3%A1todo
- Mundo da Elétrica / YouTube: https://www.youtube.com/watch?v=VyB5QuKbTlA
- Revista Galileu / Globo.com: https://revistagalileu.globo.com/Tecnologia/noticia/2019/02/brasileiros-desenvolvem-bateria-mais-eficiente-e-sustentavel.html
- Wikipédia: https://pt.wikipedia.org/wiki/Bateria_(eletricidade)
- Guia do Estudante / Abril: https://guiadoestudante.abril.com.br/blog/duvidas-portugues/a-grosso-modo-ou-grosso-modo/
- Dicionário Michaelis – Consulte também a versão de Informática do Michaelis
- Wikipédia: https://pt.wikipedia.org/wiki/Bateria_de_i%C3%A3o_l%C3%ADtio
- Manual do Mundo / YouTube: https://www.youtube.com/watch?v=T355v2v0SK8
- Site Watts On: https://www.wattson.pt/2019/01/08/7908/
- Wikipédia: https://pt.wikipedia.org/wiki/Alessandro_Volta
- História da Eletricidade / BBC / YouTube: https://www.youtube.com/watch?v=rAqUvE97iCU
- Ambiente Brasil: https://ambientes.ambientebrasil.com.br/residuos/artigos/algumas_informacoes_sobre_disposicao_de_pilhas_e_baterias.html
- Wikipédia: https://pt.wikipedia.org/wiki/Gaston_Plant%C3%A9
- STA Eletrônica: http://www.sta-eletronica.com.br/artigos/baterias-recarregaveis/baterias-de-litio/vantagens-e-limitacoes-das-baterias-de-litio-ion
- Matéria de Capa / TV Cultura: https://www.youtube.com/watch?v=pwezdsqSJG0
- Wikipédia: https://pt.wikipedia.org/wiki/Bateria_chumbo-%C3%A1cido
- Revista Superinteressante / Editora Abril: https://super.abril.com.br/mundo-estranho/como-e-feita-a-reciclagem-de-pilhas-e-baterias-2/
- Jornal da Band / UOL: https://noticias.band.uol.com.br/jornaldaband/videos/16709005/nobel-de-quimica-vai-para-criadores-de-bateria-de-litio
- Magneti Marelli (divulgação): Imagem
- Acumuladores Moura (divulgação): Imagem
- Panasonic Brasil (divulgação): Imagem
- Procter & Gamble (divulgação): Imagem
- Dreamstime: Imagem
- Wikimedia: Imagens